 Les eucaryotes vivent en étroite association avec les microorganismes qui prolifèrent dans l’environnement. Si certains, comme les bactéries commensales qui colonisent l’intestin des animaux peuvent être bénéfiques, d’autres sont pathogènes et potentiellement dangereuses pour l’hôte. Les animaux ont donc élaboré, au cours du temps, des mécanismes qui limitent les risques d’infection par les microbes potentiellement néfastes. Si cette première étape échoue, l’hôte infecté déclenche une réponse immunitaire qui éradique le pathogène. De nombreuses évidences suggèrent, qu’en parallèle de cette immunité « classique », l’hôte infecté modifie son comportement pour limiter au maximum les conséquences de cette infection sur lui-même ou sur sa descendance. Cette immunité, dite comportementale, nécessite un dialogue entre l’agent infectieux et système nerveux de l’hôte.
Les eucaryotes vivent en étroite association avec les microorganismes qui prolifèrent dans l’environnement. Si certains, comme les bactéries commensales qui colonisent l’intestin des animaux peuvent être bénéfiques, d’autres sont pathogènes et potentiellement dangereuses pour l’hôte. Les animaux ont donc élaboré, au cours du temps, des mécanismes qui limitent les risques d’infection par les microbes potentiellement néfastes. Si cette première étape échoue, l’hôte infecté déclenche une réponse immunitaire qui éradique le pathogène. De nombreuses évidences suggèrent, qu’en parallèle de cette immunité « classique », l’hôte infecté modifie son comportement pour limiter au maximum les conséquences de cette infection sur lui-même ou sur sa descendance. Cette immunité, dite comportementale, nécessite un dialogue entre l’agent infectieux et système nerveux de l’hôte.
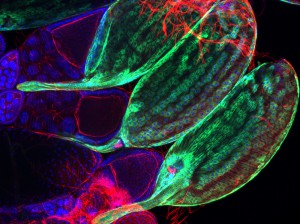
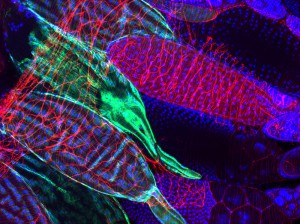 L’équipe de Julien Royet utilise les outils génétiques générés chez l’insecte drosophile pour disséquer les interactions moléculaires entre les bactéries et le système nerveux de l’hôte. Dans un article dont les auteurs principaux sont Ambra Masuzzo et Léopold Kurz, l’équipe démontre que la détection directe d’un composant de la paroi bactérienne appelé peptidoglycane, par seulement 2 neurones octopaminergiques sur les quelques 100.000 que contient le cerveau de la mouche, suffit à modifier le comportement des drosophiles femelles infectées. En inhibant l’activité de ces deux neurones, le peptidoglycane réduit la ponte des mouches infectées, leur permettant d’allouer plus d’énergie à l’élimination du pathogène.
L’équipe de Julien Royet utilise les outils génétiques générés chez l’insecte drosophile pour disséquer les interactions moléculaires entre les bactéries et le système nerveux de l’hôte. Dans un article dont les auteurs principaux sont Ambra Masuzzo et Léopold Kurz, l’équipe démontre que la détection directe d’un composant de la paroi bactérienne appelé peptidoglycane, par seulement 2 neurones octopaminergiques sur les quelques 100.000 que contient le cerveau de la mouche, suffit à modifier le comportement des drosophiles femelles infectées. En inhibant l’activité de ces deux neurones, le peptidoglycane réduit la ponte des mouches infectées, leur permettant d’allouer plus d’énergie à l’élimination du pathogène.
En Savoir Plus :
-
Peptidoglycan-dependent NF-κB activation in a small subset of brain octopaminergic neurons controls female oviposition.
Ambra Masuzzo, Gérard Manière, Annelise Viallat-Lieutaud, Émilie Avazeri, Olivier Zugasti, Yaël Grosjean, C Léopold Kurz, Julien Royet
-
Article sur le site du CNRS



